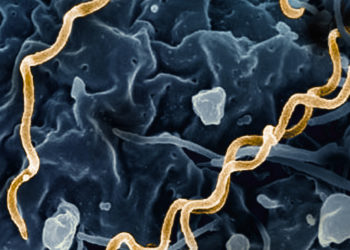
Depuis janvier 2014, séquencer un génome humain entier ne coûte plus que 1000 dollars, et bientôt encore moins. La technologie s’améliore vite, au point de concrétiser bientôt des soins basés spécifiquement sur le patrimoine de chacun. Les défis éthiques qui accompagnent cette nouvelle médecine personnalisée sont nombreux
Mille dollars. Un seuil symbolique. Pouvoir séquencer l’entier du génome d’un être humain pour moins d’un millier de dollars, en quelques heures, ouvrirait la voie à une augmentation sans précédent du savoir médical, qui nourrirait ce qui semble être devenu le Graal de la médecine du XXIe siècle: les soins personnalisés.
Ce seuil vient d’être franchi. La société californienne Illumina a présenté en janvier dernier sa nouvelle génération de séquenceurs de gènes, HiSeq X Ten, capables de séquencer l’ADN de 60 individus en un jour. Que nous promet ce décryptage rapide et bon marché? Faut-il craindre pour notre «intimité génétique»?
«Mille dollars, c’est un chiffre dont nous parlions dans les années 2000, une frontière au-delà de laquelle on s’imaginait pouvoir faire sans limite telle ou telle démarche scientifique», se souvient Patrick Descombes, responsable du département de génomique fonctionnelle au Nestlé Institute of Health Sciences, sis dans le parc scientifique de l’EPFL. Même enthousiasme chez Vincent Mooser, directeur de la Biobanque institutionnelle lausannoise au CHUV: «La technologie s’est développée à une vitesse qui a dépassé nos attentes!»
Le premier séquençage d’un génome humain, publié en 2003, a pris plus de dix ans, pour un coût de 3 milliards de dollars, soit un franc par paire de bases d’ADN décodée. En une décennie, les progrès dans l’analyse génétique ont été fulgurants: amélioration du débit du séquençage, diminution des coûts – pour séquencer un génome humain, il fallait, jusqu’à l’an dernier, compter entre 3000 et 10 000 dollars. «Et demain ou plus tard, ce sera 500 dollars, ou moins», prévoit Vincent Mooser, qui souligne qu’il faudra rester vigilant sur la qualité de l’analyse fournie.
Pour lui, il ne fait aucun doute qu’un cap a été franchi, et qu’il faudra composer avec cette nouvelle donne sur les plans scientifique et médical mais aussi politique et sociétal. Un sentiment en demi-teinte, où l’enthousiasme est mâtiné de questionnement, qui se retrouve chez nombre de ses confrères: «Il faut se demander à qui et à quoi cette nouvelle génération de séquenceurs à haut débit va servir.» Allons-nous voir bientôt les hôpitaux s’équiper de telles machines dernier cri, pour permettre aux médecins d’adapter leur diagnostic de manière très personnalisée? «Attention, clame Vincent Mooser. Pour que cette «médecine génomique» réalise tout son potentiel, il faudra encore d’énormes investissements, et des années. Il sera nécessaire que, d’ici là, la recherche arrive à traduire les données en informations, puis en connaissances et faire en sorte que ce savoir bénéficie au patient.»
Depuis le décodage du génome humain, moult équipes de recherche se sont attelées à comprendre les liens entre les variations existant parmi les gènes, appelées polymorphismes, et les maladies les plus communes. Les espoirs étaient grands de trouver des polymorphismes expliquant le diabète ou l’hypertension, pour ensuite traiter les patients selon leurs spécificités génétiques. «Le nombre de ces polymorphismes va encore exploser avec les nouvelles technologies. Cependant, une toute petite minorité de ces découvertes se sont montrées cliniquement utiles pour l’instant», assène Vincent Mooser.
Autre souci: les scientifiques ont d’abord concentré leurs recherches sur les variations génétiques les plus fréquentes, tant ils étaient limités techniquement par la taille des populations qu’ils pouvaient étudier. Or ce sont sans doute les polymorphismes les plus rares qui font sens lorsqu’on parle de médecine personnalisée. Mais là aussi, «ces séquenceurs de nouvelle génération vont permettre une réelle avancée, relève Patrick Descombes. Car plus ce que vous recherchez est rare, plus il faut passer au crible un grand nombre de génomes.» Selon la société Illumina, une seule machine HiSeq X Ten permettrait de décoder 20 000 génomes par an.
Bien qu’encore à leur début, les recherches visant à corréler des mutations génétiques avec certaines maladies progressent rapidement. A la Faculté de médecine de l’Université de Genève par exemple, l’équipe de Stylianos Antonarakis a annoncé le 4 février la mise au point d’un logiciel informatique permettant, sur la base d’algorithmes probabilistiques appliqués à des registres de génomes séquencés, d’identifier ou d’exclure les variants causatifs de diverses affections. Baptisé VariantMaster et mis à disposition sur Internet, cet instrument a été téléchargé une centaine de fois en un mois, ce qui démontre l’intérêt de la communauté scientifique, selon l’équipe genevoise.
«Avoir du très haut débit est excellent, reprend Vincent Mooser. Mais pour que la connaissance progresse, cela suppose que l’on puisse «nourrir les séquenceurs» et lier les informations génétiques avec des données cliniques de qualité». C’est là un autre paradoxe de cette médecine que l’on rêve faite sur mesure: avant d’exister pleinement, elle nécessite que des dizaines de milliers, voire des millions de personnes – et pas seulement des malades – acceptent de faire don de leur ADN et de leurs données médicales pour constituer des bases de référence. Un tournant encore à survenir.
Au-delà du pur diagnostic, c’est paradoxalement dans la personnalisation de certains traitements que l’analyse génétique trouve déjà des applications. L’idée de la pharmacogénétique consiste à mieux cibler l’administration de médicaments ou de minimiser leurs effets secondaires désagréables en fonction du profil ADN du patient.
Des exemples existent: l’Agence européenne du médicament recommande depuis 2008 un test génétique avant la prise d’un antirétroviral (l’Abacavir), car certaines personnes séropositives étant porteuses d’un polymorphisme particulier (HLA B*5701) peuvent mal tolérer ce traitement. De même, en oncologie, des analyses génomiques permettent d’optimiser la chimiothérapie en fonction des altérations génétiques repérées dans la tumeur.
«Les questions relatives à l’étude de l’ADN ne sont pas intrinsèquement modifiées par le franchissement de ce seuil technologique qu’est le génome à 1000 dollars, résume Vincent Mooser. Mais elles vont faire évoluer l’encadrement de ces recherches un peu plus vite.» Grâce à l’établissement de structures comme la Biobanque lausannoise, un cadre légal pour les recherches en génétique humaine a pu être mieux défini. Le canton de Vaud s’est doté en décembre 2013 d’un Groupe d’experts sur le génome humain. Très attentive aux risques éthiques que peut soulever la généralisation du séquençage d’ADN, cette entité a pour mission de «proposer des orientations sur les questions ayant trait à la génomique, pouvant conduire à des initiatives de l’Etat dans les domaines de la santé publique, de la recherche et de la formation».
Le Centre d’évaluation des choix technologiques TA-Swiss s’est aussi penché sur les risques liés au développement des diagnostics génétiques dans le cadre de son étude sur la médecine personnalisée, achevée fin 2013 et dont les conclusions devraient être disponibles sous peu. Quant à l’Académie suisse des sciences médicales, elle estime dans sa nouvelle feuille de route qu’«une meilleure intégration de l’épidémiologie ainsi que de la génétique et de la statistique médicale dans la formation des médecins, de même que des offres spécifiques de formation continue sont indispensables».
Avec les séquenceurs de nouvelle génération, l’analyse génétique va entrer dans l’ère du big data, produisant des montagnes de données qu’il s’agira de stocker, de traiter, d’analyser et surtout de crypter afin de protéger l’intimité génétique des citoyens. Ceci afin d’éviter que le génome de chacun puisse être piraté ou surveillé comme l’ont été courriels, SMS ou appels téléphoniques.
Bertrand Kiefer, membre de la Commission nationale d’éthique dans le domaine humain, reste perplexe devant la facilité avec laquelle de nombreuses personnes confient aujourd’hui leur ADN à des compagnies privées pour obtenir des «prédictions» sommaires sur leur santé et une évaluation de leurs risques à développer telle ou telle maladie: «Les gens le font pour se rassurer sans doute, mais il y a aussi une dimension narcissique non négligeable, qui colle à la société actuelle.»
Faut-il s’attendre à voir fleurir sur les profils Facebook des «partages de génome»? «Ça viendra peut-être, sourit-il. Nombre de gens ne se rendent pas compte des risques liés à l’utilisation des données contenues dans leur ADN. Or si l’utilisation des connaissances génétiques reste encore limitée, qu’en sera-t-il demain? Il faut que le public soit sensibilisé à cette question afin que les données génétiques ne soient pas utilisées contre les intérêts des personnes et qu’elles ne fassent pas l’objet d’un quelconque commerce.»